Gli anticorpi sono glicoproteine secrete da linfociti B specializzati denominati plasmacellule. [1]
La molecola di un anticorpo ha una forma a «Y» formata da 2 identiche catene pesanti e 2 identiche catene leggere (figura 1). [1,2]
Ciascuna di queste catene contiene molteplici regioni costanti (C) e variabili (V) legate da ponti disolfuro.
La regione di legame dell’antigene (Fab) si trova all’apice del braccio, mentre la regione effettrice si trova nella coda (Fc). [1]
Figura 1. Struttura e principale meccanismo d’azione degli anticorpi [2]
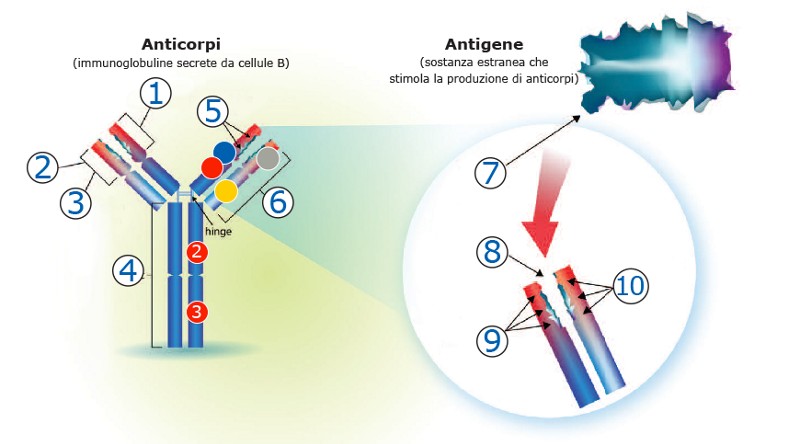
Figura 1 in Rif. 2
1 - Regione variabile della catena pesante
2 - Fv = frammento variabile
3 - Regione variabile della catena leggera
4 - Fc
5 - Regioni ipervariabili
6 - Fab
7 - Epitopo (sito di legame dell’anticorpo)
8 - Paratopo (sito di legame dell’antigene)
9 - Regioni ipervariabili della catena pesante
10 - Regioni ipervariabili della catena leggera
VH = regione variabile delle catene pesanti
VL = regione variabile delle catene leggere
CL = regione costante delle catene leggere
CH = regione costante delle catene pesanti
L’anticorpo lega in modo specifico un determinato antigene a livello delle regioni ipervariabili, delle catene leggere e pesanti, site sul frammento Fab.
Il frammento cristallizzabile (Fc) è responsabile della funzione effettrice attraverso il legame con il suo recettore sito sulle cellule effettrici; ciò determina l’interazione della risposta umorale, determinata dagli anticorpi, con la risposta cellulare. [2]
Gli anticorpi agiscono attraverso vari tipi di effetti, diretti ed indiretti (figura 2). [2]
1 - Molti anticorpi monoclonali utilizzano le regioni variabili per determinare un effetto diretto sul loro obiettivo biologico. Gli effetti diretti possono essere determinati dal legame con:
Recettori posti sulla superficie cellulare
Proteine legate o associate alle membrane
Fattori di crescita
Proteine circolanti. [2]
2 - Altri anticorpi, dopo aver legato l’antigene con il frammento Fab, agiscono in modo indiretto attraverso il frammento Fc. In questo caso l’anticorpo si lega alla cellula bersaglio e recluta cellule effettrici con la capacità di espletare una citotossicità cellulare anticorpo-dipendente oppure cellule in grado di effettuare la fagocitosi come le cellule natural killer e i monociti/ macrofagi. [2] La fagocitosi è il processo con cui le cellule inglobano al loro interno il materiale da eliminare e poi lo degradano utilizzando enzimi specifici.
3 - Un altro meccanismo indiretto è quello in cui l’anticorpo, dopo aver legato l’antigene, attiva una cascata enzimatica, denominata complemento, che determina la morte della cellula bersaglio. [2]
4 - Infine, gli anticorpi monoclonali possono essere legati (immunoconiugazione) con farmaci, tossine radioisotopi o citochine per consentire il rilascio specializzato di agenti terapeutici o diagnostici. [2]
Figura 2.
Alcuni meccanismi con i quali agiscono gli anticorpi monoclonali impiegati in oncologia
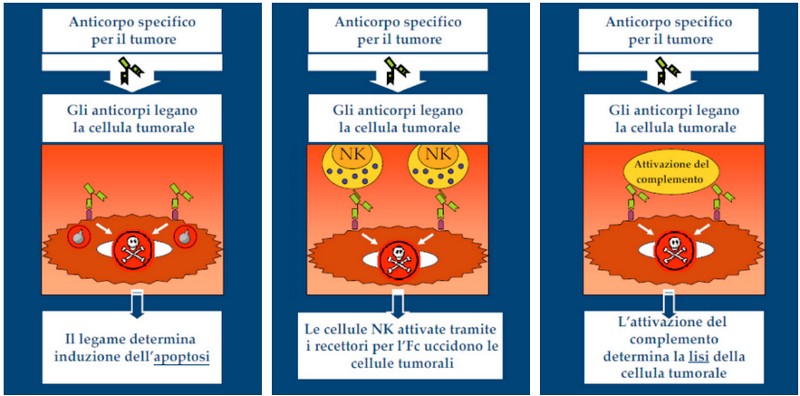
Figura 1 in Rif. 2
Gli anticorpi monoclonali offrono delle nuove opportunità per il trattamento di diverse patologie, in quanto dotate (in contrasto con piccole molecole farmacologiche) di un’elevata specificità per il bersaglio biologico, non subiscono metabolismo epatico o renale, e consentono somministrazioni meno frequenti, sebbene per via parenterale. [2]
Dal punto di vista della sicurezza, anticorpi monoclonali sviluppati oggi sono stati progettati
per ridurre il rischio di effetti negativi correlati al bersaglio biologico o alla modalità d’azione. L’evoluzione del campo degli anticorpi monoclonali ha facilitato la transizione da anticorpi monoclonali murini e chimerici a quelli umanizzati e, più recentemente, a quelli completamente umani, nel tentativo di ridurre il rischio di immunogenicità. [2]
Gli anticorpi monoclonali sono il settore dell’industria biofarmaceutica con la più ampia e rapida crescita. Le loro attuali principali applicazioni terapeutiche sono:
l’oncologia
le malattie infiammatorie croniche
le infezioni. [3]
Struttura molecolare di un anticorpo monoclonale
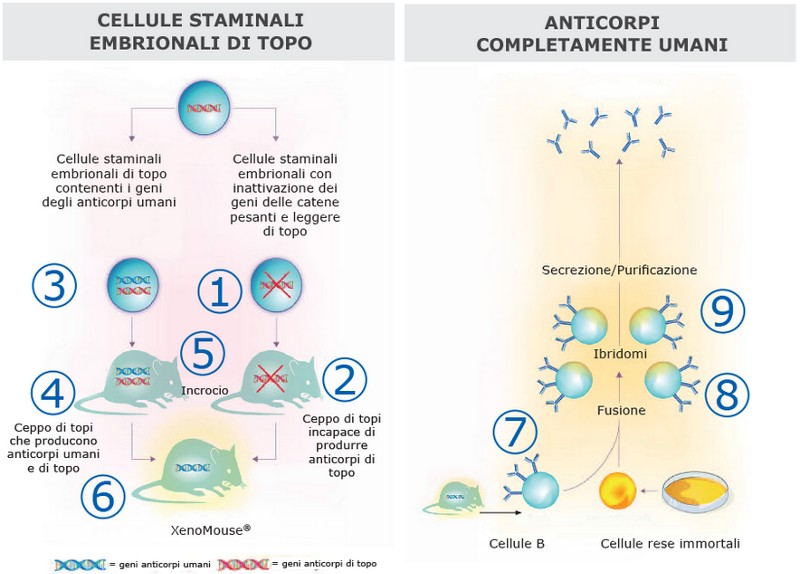
Figura 3 in Rif. 4
1 - In cellule staminali embrionali di topo sono stati inattivati i geni preposti alla sintesi delle catene pesanti e leggere degli anticorpi murini.
2 - Con queste cellule sono stati generati topi omozigoti che avevano perso la capacità di formare anticorpi di topo.
3 - In altre cellule staminali embrionali di topo sono stati introdotti i geni per la sintesi degli anticorpi umani.
4 - Con queste cellule sono stati generati topi transgenici in grado di produrre sia anticorpi umani sia anticorpi di topo.
5 - I topi che avevano perso la capacità di produrre gli anticorpi di topo sono stati incrociati con i topi transgenici (con anticorpi sia umani sia di topo).
6 - Da questo incrocio è stato ottenuto un ceppo di topi in grado di produrre anticorpi completamente umani e incapace di produrre anticorpi di topo.
7 - I topi sono stati immunizzati e dalla loro milza sono state isolate le cellule-B in grado di produrre anticorpi.
8 - Le cellule-B sono state fuse con linee cellulari rese immortali ottenendo degli ibridomi.
9 - La tecnologia degli ibridomi è stata, infine, utilizzata per produrre anticorpi monoclonali completamente umani.
Questa tecnologia è particolarmente vantaggiosa dal punto di vista produttivo, perché ogni ibridoma può produrre grandi quantità di anticorpi identici completamente umani, può essere coltivato indefinitamente e selezionato per identificare anticorpi con la specificità, l’affinità e l’attività mirata desiderate. [4]
Struttura molecolare di un anticorpo monoclonale
Ogni anticorpo monoclonale presenta profilo unico, in relazione a: [5]
regione di legame con l’antigene funzione effettrice citotossica dell’Fc
legame ai recettori dell’Fc
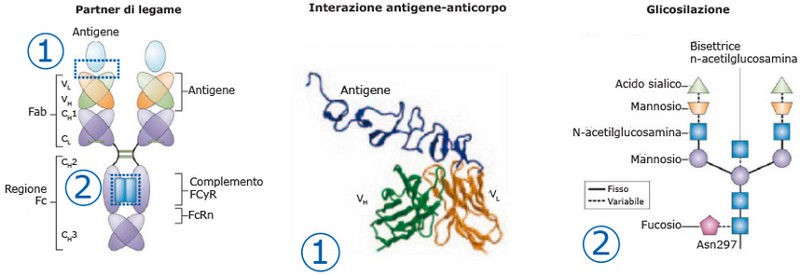
Elaborazione grafica da riferimento 6
Potenziale impatto sulla modifica dell’interazione [4]
affinità o specificità di legame alterate
attività ADCC o CDC ridotte o aumentate
Farmacocinetica alterata
Bibliografia
Lipman NS et al. Monoclonal versus polyclonal antibodies: distinguishing characteristics, applications, and information resources. ILAR J 2005; 46(3): 258-268.
Foltz IN et al. Evolution and emergence of therapeutic monoclonal antibodies: what cardiologists need to know. See comment in PubMed Commons below. Circulation 2013; 127(22): 2222-2230.
Zola, Heddy, Thomas, Daniel, and Lopez, Angel(Sep 2013) Monoclonal Antibodies: Therapeutic Uses. In: eLS. John Wiley & Sons Ltd, Chichester. http://www.els.net [doi: 10.1002/9780470015902.a0002176.pub3].
Carter PJ. Potent antibody therapeutics by design. Nat Rev Immunol 2006;6(5):343-57.



